Biomarcatori prognostici e predittivi nel mpm: una nuova era?
Introduzione
Il mesotelioma pleurico maligno (MPM) ha un comportamento aggressivo e gli attuali approcci terapeutici sono generalmente insufficienti a modificare la prognosi infausta che caratterizza i pazienti oncologici affetti da questa patologia. Inoltre, è importante ricordare che l’aspettativa di vita del MPM è definita da fattori prognostici noti quali la stadiazione e la classificazione istologica. Tuttavia, non esistono predittori validati della risposta al trattamento o degli esiti a lungo termine, quali la sopravvivenza globale o la sopravvivenza libera da progressione di malattia. Numerosi sono gli studi che hanno esaminato biomarcatori ideali come approccio predittivo o prognostico al MPM: tra questi sono stati analizzate sostanze presenti sia nel liquido pleurico che nel sangue per validare se un’analisi mininvasiva di questi elementi potesse fornire informazioni precoci sulla malattia.
Come è noto, tra i marcatori più studiati nel versamento pleurico è la mesotelina, che mostra una buona specificità ma una bassa sensibilità, soprattutto per il MPM non epitelioide. Altri biomarcatori trovati nel liquido pleurico includono la fibulina-3, lo ialuronano, i microRNA e il CYFRA-21.1 ed hanno capacità diagnostiche inferiori rispetto alla mesotelina, ma forniscono informazioni prognostiche e hanno un ruolo potenziale come bersagli terapeutici.
Il siero è la matrice più studiata per i biomarcatori del MPM.
A questo proposito, sono stati studiati diversi biomarcatori sierici del PM, tra questi, la mesotelina, l'osteopontina e la fibulina-3 sono i più frequentemente testati. Il peptide solubile legato alla mesotelina (SMRP) è l'unico biomarcatore approvato dalla FDA nei pazienti con sospetto mesotelioma, per fornire informazioni utili riguardanti diagnosi, prognosi, follow-up e risposta alla terapia nel MPM epitelioide. Per quanto riguarda le prospettive future, i pannelli che combinano diversi marcatori e tecnologie proteomiche sono promettenti in termini di miglioramento delle prestazioni cliniche nella diagnosi e nel monitoraggio della malattia in corso di trattamento specifico. In questo panorama si potrebbe scorgere l’inizio di una nuova era: ottenere importanti informazioni sulla malattia e sul paziente affetto da MPM, tramite analisi poco costose, ripetibili e mininvasive: la scoperta di biomarcatori prognostici e predittivi ideali.
Quali biomarcatori sono disponibili oggi?
La ricerca di biomarcatori utili per il MPM ha suscitato da tempo un grande interesse, con tre principali finalità potenziali:
1) lo screening nelle persone a rischio (sia esposte all'amianto che familiari nei casi di MPM "geneticamente correlati");
2) il miglioramento del processo diagnostico nei pazienti con versamento pleurico o altre anomalie, come l'ispessimento pleurico aspecifico;
3) la valutazione della risposta al trattamento e la valutazione prognostica.
In questo contesto, il rilevamento di biomarcatori solubili o del liquido pleurico del MPM potrebbe essere utile per ridurre la necessità di procedure invasive nei pazienti con scarso performance status.
Le linee guida 2018 della British Thoracic Society per l'indagine e la gestione del MPM raccomandano di prendere in considerazione l'analisi dei biomarcatori solo nei pazienti con citologia sospetta, che non sono sufficientemente idonei per test diagnostici più invasivi, mentre questi predittori biologici non vengono suggeriti per lo screening o la diagnosi del MPM, né per predire la risposta al trattamento o la sopravvivenza [16].
L'European Respiratory Society (ERS/Società Europea di Chirurgia Toracica (ESTS)/Associazione Europea di Chirurgia Cardio-Toracica (EACTS)/Società Europea di Radioterapia e Oncologia (ESTRO) 2020) per la gestione del MPM non suggerisce la determinazione di routine della mesotelina o di altri biomarcatori per la diagnosi, lo screening o la valutazione prognostica, in assenza di chiare evidenze scientifiche sulla loro utilità [17].
I metodi di screening dovrebbero essere test minimamente invasivi ed economicamente vantaggiosi, in grado di identificare il MPM nella popolazione di soggetti esposti all'amianto, al fine di trattare potenzialmente la malattia in fase precoce.
Sebbene sia auspicabile disporre di test molto sensibili e specifici, per lo screening di soggetti asintomatici è fortemente raccomandata un'elevata specificità per ridurre il numero di falsi positivi, nonché le conseguenti procedure inutili e lo stress psicologico per i soggetti coinvolti [18]. Un'elevata specificità è necessaria anche per i test che riguardano la diagnosi differenziale delle lesioni pleuriche, la maggior parte delle quali si ottiene con le biopsie pleuriche. Il tasso di complicanze, la morbilità e i costi associati alle biopsie pleuriche dipendono dalla procedura utilizzata per ottenere il campione, come la toracoscopia medica, la chirurgia toracica e la biopsia guidata da immagini transtoraciche [19].
La definizione diagnostica del MPM e la sua distinzione dalle lesioni non maligne sono cruciali per prendere decisioni gestionali che coinvolgano il paziente e i familiari.
Nonostante sia relativamente invasiva, la toracoscopia medica o chirurgica può consentire la diagnosi e la stadiazione e, allo stesso tempo, offrire trattamenti definitivi per contrastare l'insorgenza del versamento pleurico maligno (ad esempio, posizionamento di un catetere pleurico indwelling e/o pleurodesi palliativa) [20].
Negli ultimi due decenni, diversi studi hanno indagato i marcatori diagnostici e prognostici del MPM, ma ad oggi i predittori più affidabili dell'esito della malattia sono ancora i parametri clinici e patologici. In particolare, l'istologia non epitelioide, lo scarso rendimento, il sesso maschile, l'anemia, la trombocitosi, la leucocitosi, l'LDH elevato, l'età avanzata e la malattia avanzata sono indicatori prognostici sfavorevoli nei pazienti con PM. Molti di questi parametri sono inclusi nei sistemi di punteggio più diffusi per il MPM, ovvero quello dell'Organizzazione Europea per la Ricerca e il Trattamento del Cancro (EORTC) e del Cancerand Leukemia Group B (CALGB). Sono stati introdotti oltre 20 anni fa e rimangono validi, anche se molti studi hanno cercato di aggiornarli, di identificare ulteriori biomarcatori prognostici e di sviluppare modelli che combinano caratteristiche cliniche e molecolari [21,22].
I biomarcatori candidati possono essere molecole con caratteristiche diverse, come proteine o loro frammenti, acidi nucleici, lipidi e metaboliti. Di conseguenza, i metodi per la loro identificazione variano notevolmente.
Gli approcci basati sulla proteomica, come quelli basati sulla spettrometria di massa, sono strumenti promettenti e sono stati sempre più implementati per identificare e quantificare le biomolecole in una varietà di campioni biologici.
La valutazione degli acidi nucleici è più complessa, in quanto richiede l'estrazione, la quantificazione e la purificazione dell'RNA, con i campioni conservati a temperature molto basse (-80 °C). L'RNA purificato viene poi trascritto in reverse in cDNA, che, a sua volta, viene amplificato mediante una reazione a catena della polimerasi (PCR).
La valutazione degli acidi nucleici e, ancor più, la proteomica hanno costi elevati e pongono problemi di accessibilità nei Paesi a basso reddito.
I biomarcatori pleurici
Molte molecole presenti nel liquido pleurico sono state studiate come potenziali biomarcatori di malignità.
In particolare, i biomarcatori del liquido pleurico sono strumenti diagnostici potenzialmente promettenti per il MPM, che in circa la metà dei casi si manifesta con un versamento pleurico. Tuttavia, il valore diagnostico dei biomarcatori più studiati per la MPM nel versamento pleurico è ancora in gran parte da definire [17].
In questo contesto, la maggiore attenzione della comunità scientifica è stata rivolta alla mesotelina e ai peptidi solubili correlati alla mesotelina (SMRPs), alla fibulina-3, all'osteopontina e ai microRNA cell-free.
In una recente meta-analisi sui marcatori di PM, il 36% degli studi inclusi li ha ricercati nei versamenti pleurici. Le proteine sono state i biomarcatori più studiati (89%), mentre DNA e miRNA sono stati studiati solo nel 5,5% [25].
LA MESOTELINA
La mesotelina è una proteina normalmente presente nelle cellule mesoteliali della pleura, del peritoneo e del pericardio. Sembra svolgere un ruolo nell'adesione cellulare, ma è probabilmente un componente non essenziale nelle cellule normali.
La mesotelina è sovraespressa in alcuni tumori maligni, come il MPM, ma anche negli adenocarcinomi del pancreas, dell'ovaio e del polmone [47]. Per questo motivo, questa proteina può essere considerata un biomarcatore interessante per la diagnosi del PM, per lo screening delle persone esposte all'amianto, per il monitoraggio della progressione della malattia e come potenziale bersaglio per la terapia del cancro [48].
Diversi studi pionieristici sulla mesotelina hanno rilevato che gli individui con il sottotipo epitelioide presentavano l'espressione della mesotelina, mentre quelli con il sottotipo sarcomatoso erano tutti negativi per questo biomarcatore, inoltre, nei pazienti con MPM bifasico, solo la componente epiteliale evidenziava la positività per mesotelina [50] [51] [52]. Di conseguenza, un'immunocolorazione positiva per la mesotelina suggerisce un MPM epitelioide, sebbene non sia assolutamente specifica.
Le meta-analisi di Gao et al. [26] e Cui et al. [27] hanno valutato l'accuratezza diagnostica degli SRMP sul liquido pleurico per la diagnosi di MPM. Hanno analizzato le concentrazioni di SMRP in 13 e 11 studi, rispettivamente, e tutti hanno riportato livelli più elevati di mesotelina nei pazienti affetti da MPM rispetto ai controlli. Complessivamente, gli autori hanno concluso che il MPM può essere sospettato quando le SMRP nel versamento pleurico sono superiori a 8 nmol/L, mentre valori superiori a 20 nmol/L sono fortemente suggestivi.
Una meta-analisi più recente di Schillebeeckx et al. [25] ha incluso 19 studi che hanno valutato l'efficacia diagnostica della mesotelina nel versamento pleurico. I valori di cut-off variavano da 6 nM (dove la sensibilità e la specificità erano rispettivamente del 72% e del 46%) a 6 nM.
FIBULINA-3
La fibulina-3 è una glicoproteina codificata dal gene fibulin-likeextracellular matrix protein 1 contenente il fattore di crescita epidermico. Ha un ruolo nella proliferazione e nella migrazione cellulare [53,54].
La fibulina-3 ha una bassa espressione nei tessuti normali, ma è sovraespressa in diversi tumori, tra cui il MPM, ed è anche secreta nei fluidi corporei. Si accumula nelle effusioni pleuriche dei pazienti affetti da MPM ed è stata proposta per distinguere questi pazienti da individui con infiammazione pleurica non maligna [28]. Questi risultati non sono stati confermati da altri studi che hanno riscontrato valori simili di fibulina nei versamenti da mesotelioma e da altre malattie [55].
Un'analisi comparativa ha suggerito che la fibulina-3 correla meno accuratamente della mesotelina con la diagnosi di PM, sia che venga misurata nel plasma che nel versamento pleurico; di conseguenza, la mesotelina è stata riconosciuta come il miglior marcatore pleurico utilizzabile per scopi diagnostici di routine [56,57]. Al contrario, la fibulina-3 è stata proposta come un fattore prognostico migliore della PM; prove sincere suggeriscono che la fibulina-3 promuove il comportamento maligno delle cellule mesoteliali, mentre il knockdown della fibulina-3 diminuisce la vitalità, la capacità clonogenica e l'invasione, nonché la chemioresistenza, nelle cellule PM.
ACIDO IALURONICO
Lo ialuronano, o acido ialuronico (HA) è un polisaccaride che sembrerebbe implicato nella progressione di diversi tipi di neoplasie [58]. Diversi studi scientifici hanno dimostrato alti livelli di HA nei versamenti pleurici associati al mesotelioma [29], a causa del rilascio di fattori di crescita dalle cellule tumorali che possono stimolare altre cellule a produrre HA [59]. L'HA viene rapidamente rimosso dalla circolazione dal recettore di clearance stabilin-2 e ha un'emivita plasmatica di 2,5-5 minuti[29]. In passato, per misurare l'acido ialuronico mediante cromatografia liquida ad alta prestazione era necessaria un'elevata competenza tecnica, che ha limitato il numero di studi su questo biomarcatore.
Ricerche più recenti, che utilizzano sistemi di analisi più rapidi ed alla portata di ogni laboratorio scientifico, hanno dimostrato che i livelli di mesotelina e acido ialuronico nel versamento pleurico hanno simile accuratezza diagnostica e che la combinazione dei due marcatori potrebbe migliorare l'accuratezza diagnostica [60].
I microRNA
I microRNA sono brevi molecole di RNA non codificanti a singolo filamento che regolano l'espressione dei geni a livello post-trascrizionale. Tali molecole influenzano l'andamento di molti importanti processi dell'organismo umano, tra cui la divisione cellulare, la proliferazione, la differenziazione, l'apoptosi e la formazione dei vasi sanguigni.
Alcuni studi hanno valutato i livelli sierici di diversi microRNA come marcatori di mesotelioma maligno, mentre rare sono le ricerche di tale biomarcatore nel liquido pleurico [30]. Gli autori hanno analizzato i microRNA nelle cellule e nei surnatanti del versamento pleurico di 26 pazienti con MPM e 21 con versamento pleurico causato a condizioni diverse dal MPM. I ricercatori hanno riscontrato che quattro microRNA (miR-944, miR-139-5p, miR-210 e miR-320) trovati nel versamento pleurico erano upregolati e sette (miR-200b, miR-200c, miR-143, miR-200a, miR-203, miR-31 e miR-874) erano downregolati. Una combinazione di miR-143, miR-210 e miR-200c è stata in grado di differenziare il MPM da versamenti pleurici causati da altre patologie.
CYFRA-21-1 e CEA
Il CYFRA-21-1 è il frammento solubile della citocheratina 19. Può essere rilasciato in circolo dopo la morte delle cellule, mostrando così una stretta relazione con la necrosi e l'apoptosi delle cellule tumorali.
Il CYFRA-21-1 si trova nel sangue di pazienti con diverse neoplasie epiteliali, tra cui il carcinoma polmonare non a piccole cellule (NSCLC), ed è stato utilizzato come marcatore utile per predire la diagnosi e la prognosi [62].
Sebbene il CYFRA-21-1 non sia stato ampiamente studiato nel MPM, tutti gli studi che lo hanno misurato nel versamento pleurico hanno rilevato livelli più elevati nei pazienti con tale patologia neoplastica rispetto ai controlli [31,63,64]. Tuttavia, l'accuratezza diagnostica è risultata modesta.
Il CEA è una glicoproteina coinvolta nell'adesione cellulare.
Negli individui sani, livelli molto bassi di CEA sono rilevabili nel flusso sanguigno e nei fluidi corporei, mentre il suo aumento è stato riportato in diverse patologie tra cui anche quelle neoplastiche.
Due studi che hanno misurato il CEA nel liquido pleurico ne hanno riportato l'aumento nel MPM [31,65], mentre un’altra ricerca ha dimostrato che il CEA pleurico nel MPM era meno elevato rispetto ad altri tipi di cancro, suggerendo che livelli di CEA superiori a 3 ng/mL nel liquido pleurico possono escludere la diagnosi di tale patologia pleurica [64].
Tuttavia, il CEA è attualmente di scarsa accuratezza diagnostica e non è raccomandato come biomarcatore diagnostico differenziale per il MPM [25].
PANNELLI DI MARCATORI IN COMBINAZIONE
In uno studio che mirava a stabilire un modello predittivo utilizzando i biomarcatori provenienti dalle effusioni pleuriche, sono stati raccolti campioni da 190 pazienti consecutivi [66].
I biomarcatori significativamente associati con il MPM erano ialuronano, N-ERC/mesotelina, C-ERC/mesotelina e sindecan-1.
Recentemente, un nuovo metodo proteomico basato sulla spettrometria di massa ad arricchimento di affinità è stato applicato per l'analisi esplorativa dei versamenti pleurici di una coorte prospettica di 84 individui sottoposti a toracoscopia per sospetto MPM [67]. L'immunoistologia delle biopsie pleuriche ha confermato il MPM in 40 pazienti e l’ha escluso in 44. Gli autori hanno identificato biomarcatori proteici con un'elevata capacità di discriminare i pazienti con MPM da quelli senza MPM e hanno applicato un algoritmo random forest per costruire modelli di classificazione.
A seconda della specifica combinazione di proteine, l'analisi proteomica dei versamenti pleurici ha identificato pannelli di proteine con eccellenti proprietà diagnostiche (sensibilità del 90-100%, specificità dell'89-98% e AUCROC 0,97-0,99).
Le proteine associate alla diagnosi di cancro includono la proteina legante la galactina-3, il testican-2, l'aptoglobina, la Beta ig-h3 e la proteina AMBP. Inoltre, lo studio ha confermato l'accuratezza diagnostica precedentemente riportata dei marcatori MPM fibulina-3 e mesotelina.
CITOLOGIA
Il rilevamento dell'invasione neoplastica è sempre stato un elemento chiave per diagnosticare con certezza il MPM, ma la diagnosi basata esclusivamente sulla citologia del versamento pleurico è controversa, soprattutto a causa della scarsa sensibilità [68]. La migliore resa interpretativa deriva dalla correlazione dei risultati citologici con la diagnostica per immagini, che può fornire informazioni sulla distribuzione anatomica della lesione, sull'evidenza della nodularità della malattia pleurica e, talvolta, sull'invasione tissutale.
Sebbene sia stato dimostrato che i marcatori immunoistochimici "positivi" e "negativi" sono notevolmente efficaci nel distinguere il mesotelioma epitelioide da altre neoplasie secondarie, nessun biomarcatore ha una sensibilità o una specificità del 100% per la diagnosi di mesotelioma. Per quanto riguarda l'istologia, il MPM può essere determinato direttamente dalla morfologia attraverso la colorazione con ematossilina-eosina. Tuttavia, i patologi di solito raccomandano la conferma attraverso l'immunoistochimica.
La calretina, il tumore di Wilms 1 (WT-1), la citocheratina 5 (CK5), la podoplanina, la mesotelina e la proteina dello sviluppo cardiaco con domini EGF-like 1 (HEG1) sono biomarcatori immunoistochimici della differenziazione mesoteliale, mentre il carcinoembriontigene (CEA), B72. 3, Ber-EP4, gruppo sanguigno di Lewisy (BG8), MOC-31, CD15, mucina-4 (MUC4) e claudina-4 sono marcatori suggestivi di metastasi epiteliali [2]. La perdita di espressione della proteina BAP1 mediante immunoistochimica è stata recentemente suggerita come potenziale marcatore per l'identificazione del MPM, poiché è stata osservata in più della metà dei MPM, sia epitelioidi che bifasici o sarcomatoidi [69].
I recenti progressi nell'analisi citologica promettono progressi diagnostici per i PM. Recenti studi suggeriscono che la valutazione citologica dei versamenti pleurici, coadiuvata dalla valutazione dell'HA, ha un'accuratezza diagnostica per il MPM non inferiore a quella della valutazione istologica standard e può essere presa in considerazione nei casi diagnostici difficili o dubbi.
Analogamente, un ampio database monocentrico è stato esplorato retrospettivamente per chiarire il valore della citologia nel distinguere il mesotelioma maligno secondo l'InternationalSystem for Reporting Serous Fluid Cytopathology (ISRSFC) [71]. Erano disponibili per l'analisi campioni citologici di 210 pazienti con mesotelioma maligno (164 versamenti pleurici e 46 peritoneali). Tutti i casi sono stati esaminati e riclassificati secondo lo schema proposto dall'ISRSFC. La diagnosi istologica finale è stata di mesotelioma epitelioide in 192 (91,4%) pazienti e di tipo sarcomatoide nei restanti 18 (8,6%). I casi citologici sono stati riclassificati come segue: 2 (0,9%) come non diagnostici, 81 (38,6%) come formalmente negativi, 4 (1,9%) come atipie di significato indeterminato, 11 (5,2%) come formalmente sospetti e 112 (53,4%) come maligni. Le cellule sarcomatoidi della categoria maligna apparivano solitarie, con pleomorfismi nucleari moderati o marcati e cromatina irregolare rispetto al sottotipo epitelioide. Gli autori hanno concluso che le caratteristiche morfologiche, insieme ai dati clinico-radiologici, possono aiutare i medici a gestire adeguatamente i pazienti.
I biomarcatori ematici
Il siero è la matrice più studiata per i biomarcatori del MPM; i più comuni protagonisti delle recenti ricerche sono stati: la mesotelina, l'osteopontina e la fibulina-3.
LA MESOTELINA E LA SMRP
La Mesotelina è stato il biomarcatore sierico più studiato nel MPM [73]. Una meta-analisi relativa al valore diagnostico della mesotelina solubile in 4491 pazienti ha stimato la sensibilità e la specificità di tale marcatore rispettivamente del 47% e del 95% [74]. Una più recente revisione sistematica e meta-analisi, che ha incluso 27 studi, ha mostrato una sovraespressione della proteina nei pazienti con mesotelioma maligno.
Concentrazioni più elevate di questa proteina sono state rilevate nel tipo epitelioide rispetto ad altri sottotipi di MPM [17,75,77-79].
L'aumento dei livelli di SMRP è correlato a un volume tumorale elevato [80,81].
Diversi studi hanno dimostrato che la misurazione longitudinale può essere utilizzata per valutare la risposta e la progressione del tumore e può essere associata ai risultati radiologici [82-86]. Tuttavia, alcuni ricercatori hanno recentemente confermato la correlazione di SMRP e fibulina-3 con il volume iniziale del tumore, ma gli studi più recenti non hanno confermato l'utilità clinica dei biomarcatori in termini di valutazione della risposta tumorale nei pazienti sottoposti a immunoterapia [81].
I livelli di SMRP diminuiscono dopo l'intervento chirurgico e sono un promettente biomarcatore sierico per l'individuazione della recidiva dopo la resezione del MPM epiteliale [73,87].
L'espressione della mesotelina rappresenta un criterio chiave per la selezione dei pazienti da sottoporre a trattamenti mirati con la mesotelina. Infatti, è stata studiata anche come potenziale bersaglio terapeutico nei pazienti con MPM.
OSTEOPONTINA
L'osteopontina (OPN) sierica mostra una buona accuratezza per quanto riguarda la diagnosi di MPM se confrontata con i controlli sani con o senza esposizione all'amianto, ma non ha alcuna utilità se confrontata con i versamenti pleurici benigni [25,36] e con altre patologie [37], suggerendo quindi la bassa specificità di questo marcatore.
L'OPN plasmatica mostra un'accuratezza maggiore rispetto ai marcatori sierici, come suggerito da metaanalisi e studi testa a testa [25,94-96]. Ciò potrebbe essere dovuto alla facile degradazione da parte della trombina nel sangue periferico [97].
L'OPN potrebbe avere un ruolo prognostico. Diversi studi hanno dimostrato che elevati livelli di OPN sono correlati a prognosi sfavorevoli nei pazienti con MPM [38-40,95].
FIBULINA-3
Le proprietà della fibulina-3 plasmatica come marcatore sono state riportate per la prima volta da Pass et al. nel 2012 [28]. In 507 pazienti di 3 coorti, gli autori hanno riscontrato una sensibilità e una specificità del biomarcatore del 95%, che potrebbe essere utile per distinguere il MPM dai controlli sani esposti all'amianto e dai pazienti con altre neoplasie.
Questi risultati non sono stati confermati da studi successivi [57,98-100], che hanno mostrato una minore accuratezza del biomarcatore.
Tuttavia, una recente meta-analisi che ha incluso studi sulla fibulina-3 plasmatica ha mostrato una possibile efficacia della fibulina plasmatica come marcatore utile [25].
Studi testa a testa che hanno confrontato le prestazioni diagnostiche della fibulina-3 e della mesotelina/SMRP hanno mostrato risultati contrastanti e non conclusivi [36,57].
Diverse ricerche hanno dimostrato che la fibulina-3 sierica/plasmatica non è un marcatore affidabile per la prognosi [38] o per valutare la risposta all'immunoterapia nel MPM [81].
La fibulina-3 è stata anche proposta come bersaglio molecolare rilevante per ridurre la progressione della MPM e sono in fase di studio approcci anti-fibulina-3 [88].
CALRETININA
La calretinina è una proteina legante il calcio, originariamente presente nei neuroni, ma espressa anche sulla superficie delle cellule mesoteliali.
La calretinina è ampiamente utilizzata nelle valutazioni immunoistochimiche di campioni cito-istologici di sospetto MPM, sia epitelioide che sarcomatoide [32]. La sua rilevazione nel plasma e nel siero non differisce in modo significativo e sono stati rilevati valori più elevati di calretinina circolante in soggetti con MPM rispetto a controlli sani esposti all'amianto [101].
Studi su cellule mesoteliali primarie di topo hanno suggerito che la sovraespressione della calretinina favorirebbe la proliferazione e la migrazione delle cellule mesoteliali [102]. Di conseguenza, i ricercatori hanno iniziato a ipotizzare che la calretinina possa essere un possibile biomarcatore ematico per lo screening, nonché un nuovo potenziale bersaglio terapeutico del MPM.
Gli studi hanno mostrato risultati promettenti di questo marcatore per la diagnosi precoce di MPM e per differenziare pazienti affetti da MPM rispetto a quelli esposti all'amianto e a quelli sani [33,103].
Inoltre, la calretinina, sia da sola che in combinazione con la mesotelina, è stata valutata anche in un ampio studio prospettico di coorte su soggetti con patologie benigne asbesto-correlate che hanno partecipato a screening annuali. La combinazione dei due marcatori ha ottenuto una sensibilità e una specificità del 46% e del 98%, rispettivamente, nell'individuazione del mesotelioma fino a circa un anno prima della diagnosi clinica [104].
I microRNA (miRNA) E GLI RNA NON CODIFICANTI LUNGHI (lncRNA)
Le caratteristiche dell'espressione dei miRNA sono associate al tipo di tumore e all'esito clinico, come dimostrato dal profilo genomico. Pertanto, i miRNA hanno un ruolo potenziale come candidati a biomarcatori diagnostici e prognostici e come strumenti per i bersagli terapeutici [105].
I profili di miRNA circolanti dei pazienti affetti da MPM sono stati studiati per identificare marcatori per la diagnosi precoce, la diagnosi differenziale e la prognosi. Diversi studi hanno riportato un aumento dell'espressione di miR-197-3p, miR-1281, miR-548-3p, miR-20a, miR-625-3p e miR-34b/c insieme alla downregulation di miR-126, che può essere attribuita alla sua attività di soppressione del tumore [17,90,106].
Il miR-20a ed il miR-126I sono stati studiati come marcatori di screening [25, 33, 91, 104]: potrebbero essere utili per distinguere i soggetti sani più o meno esposti all'amianto.
Alcuni ricercatori hanno dimostrato diversi livelli di espressione del miR-132 in campioni circolanti di pazienti affetti da mesotelioma e di soggetti di controllo esposti all'amianto. La sensibilità di discriminazione era dell'86% e la specificità del 61%. Quando il miR-132 è stato combinato con il miR-126 precedentemente descritto, la sensibilità è stata del 77% e la specificità dell'86% [41].
I risultati degli studi sono alquanto eterogenei e ciò può essere attribuito principalmente all'uso di gruppi di controllo diversi, alle dimensioni ridotte dei campioni e alla mancanza di standardizzazione dei metodi di rilevamento dei microRNA circolanti [24,43,45,73].
DNA TUMORALE CIRCOLANTE (ctDNA) E BIOMARCATORI EPIGENETICI
I recenti progressi nella ricerca medica hanno portato a una nuova comprensione attraverso lo studio del ctDNA e dei biomarcatori epigenomici.
Il DNA libero circolante (cfDNA), che proviene da tessuti sani e cancerosi sottoposti ad apoptosi o necrosi, ha mostrato un potenziale significativo nel campo dell'oncologia.
Al contrario, il DNA tumorale circolante (ctDNA), proveniente esclusivamente dalle cellule tumorali, porta mutazioni somatiche e rappresenta solo una minima parte del cfDNA [108].
Questa scoperta offre una nuova prospettiva per i pazienti affetti da MPM precedentemente non trattati.
Nel 2018, Hylebos e colleghi hanno eseguito un'analisi completa di 10 pazienti affetti da MPM utilizzando sequenziatori dell'intero esoma per identificare mutazioni specifiche del cancro, sia nella linea germinale che nel DNA tumorale [109]. Sono stati in grado di rilevare queste mutazioni nei campioni di siero di cinque pazienti naïve al trattamento, ottenendo un tasso di rilevamento del 60%. È interessante notare che non sono state osservate alterazioni specifiche del tumore nel cfDNA di pazienti sottoposti a chemioterapia. Sebbene il ctDNA abbia il potenziale per essere utilizzato come biomarcatore della risposta al trattamento, saranno necessarie ulteriori convalide e tecnologie economicamente vantaggiose prima che possa essere ampiamente utilizzato nella pratica clinica di routine.
Inoltre, le modifiche epigenetiche che si verificano durante lo sviluppo del tumore sono emerse come promettenti biomarcatori rilevabili in vari fluidi corporei.
Nella carcinogenesi indotta dall'amianto, la generazione di specie reattive dell'ossigeno (ROS) porta alla metilazione dei promotori genici, orchestrata dalla polimerasi 1 (PARP1) e dalla DNA (citosina-5) metiltransferasi 1 (DNMT1) [110]. Nocchi et al. hanno introdotto un approccio innovativo combinando due marcatori regolati epigeneticamente, miR-126 e TM, con SMRP [111]. Infatti, è stato riportato che i meccanismi epigenetici possono silenziare l'espressione del gene TM nel tessuto del MPM e l'ipermetilazione della regione promotrice del miR-126 contribuisce alla sua downregulation. Nonostante un tasso di sensibilità del 60%, gli autori hanno riportato che il DNA TM metilato circolante differenziava efficacemente i pazienti con MPM dai controlli con una specificità dell'82%. Questo risultato integra le prestazioni di miR-126 e SMRP come biomarcatori indipendenti per il rilevamento della MPM [112].
Più recentemente, Guarrera et al. hanno utilizzato un array di metilazione a livello genomico per identificare modelli di metilazione distinti in corrispondenza di CpG selezionate nel DNA estratto dai globuli bianchi in una coorte di 163 pazienti con MPM e 137 controlli [113]. Questa scoperta promette di fare ulteriore luce sul panorama epigenetico della MPM e sulle sue potenziali implicazioni per la diagnosi e il trattamento.
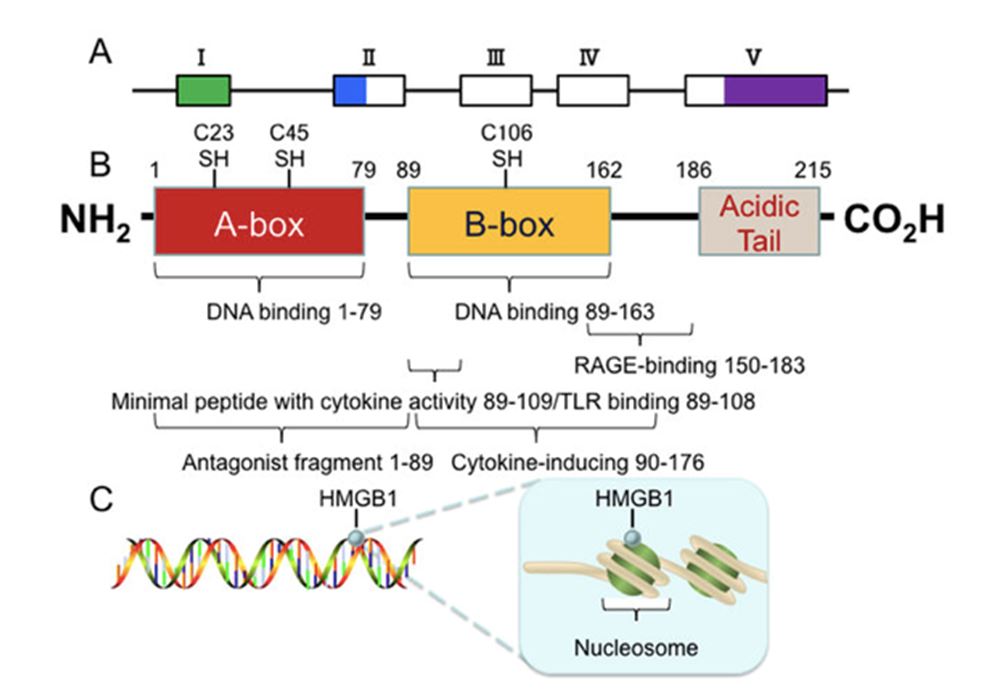
HIGH-MOBILITY GROUP BOX 1 (HMGB1)
HMGB1 è una proteina molecolare associata al danno che viene rilasciata nello spazio extracellulare durante la necrosi [37,73].
È stata considerata un promettente biomarcatore, con un'isoforma iperacetilata citoplasmatica che può essere rilasciata nello spazio extracellulare, con risultati migliori rispetto alla forma non acetilata presente nel nucleo [25,36]. Tuttavia, vi sono studi discordanti a questo proposito [114]. Sono pochi gli studi che mostrano un'elevata accuratezza del marcatore in termini di distinzione tra pazienti affetti da asbestosi e pazienti sani con e senza esposizione all'amianto [115]. Tuttavia, non sono state riscontrate differenze quando i pazienti con MPM sono stati confrontati con quelli con asbestosi e non sono disponibili studi di confronto con altre neoplasie [25,92].
Il HMGB1 potrebbe avere anche un ruolo di potenziale bersaglio per il MPM [89].
CONCLUSIONI
Come ricordato in questa revisione della letteratura, vari sono stati gli sforzi scientifici per testare e vagliare biomarcatori derivanti dal liquido pleurico o dal siero di soggetti esposti all’amianto e di pazienti affetti da MPM.
Sicuramente studi supplementari saranno necessari per confermare i dati riportati in questa review.
Tuttavia, il panorama che queste ricerche offrono al mondo attuale è estremamente interessante e mostra il ruolo potenziale dei biomarcatori nella diagnosi e prognosi del MPM, oltre che come eventuali bersagli terapeutici innovativi.
Referenze
1. Asciak, R.; George, V.; Rahman, N.M. Update on biology and management of mesothelioma. Eur. Respir. Rev. 2021, 30, 200226. [CrossRef] [PubMed]
2. Sauter, J.L.; Dacic, S.; Galateau-Salle, F.; Attanoos, R.L.; Butnor, K.J.; Churg, A.; Husain, A.N.; Kadota, K.; Khoor, A.; Nicholson, A.G.; et al. The 2021 WHO Classification of Tumors of the Pleura: Advances Since the 2015 Classification. J. Thorac. Oncol. 2022, 17, 608–622. [CrossRef] [PubMed]
3. Mlika, M.; Lamzirbi, O.; Limam, M.; Mejri, N.; Saad, S.B.; Chaouch, N.; Miled, K.B.; Marghli, A.; Mezni, F. Clinical and pathological profile of the pleural malignant mesothelioma: A retrospective study about 30 cases. Rev. Pneumol. Clin. 2018, 74, 427–435. [CrossRef] [PubMed]
4. Congedo, M.T.; West, E.C.; Evangelista, J.; Mattingly, A.A.; Calabrese, G.; Sassorossi, C.; Nocera, A.; Chiappetta, M.; Flamini, S.; Abenavoli, L.; et al. The genetic susceptibility in the development of malignant pleural mesothelioma: Somatic and germline variants, clinicopathological features and implication in practical medical/surgical care: A narrative review. J. Thorac. Dis 2023, in press.
5. Moolgavkar, S.H.; Chang, E.T.; Mezei, G.; Mowat, F.S. Epidemiology of Mesothelioma. In Asbestos and Mesothelioma; Testa, J.R., Ed.; Springer International Publishing: Philadelphia, PA, USA, 2017; pp. 43–72.
6. Price, B. Projection of future numbers of mesothelioma cases in the US and the increasing prevalence of background cases: An update based on SEER data for 1975 through 2018. Crit. Rev. Toxicol. 2022, 52, 317–324. [CrossRef] [PubMed]
7. Wen, W.; Xu, D.; Piao, Y.; Li, X. Prognostic value of maximum standard uptake value, metabolic tumour volume, and total lesion glycolysis of 18F-FDG PET/CT in patients with malignant pleural mesothelioma: A systematic review and meta-analysis. Cancer Cell Int. 2022, 22, 60. [CrossRef]
8. Zhang, Y.; Li, R.; Gu, Y.; LiZhu, Y.; Liu, X.; Zhang, S. Clinical, Laboratory, Histological, Radiological, and Metabolic Features and Prognosis of Malignant Pleural Mesothelioma. Medicina 2022, 58, 1874. [CrossRef]
9. Royal College of Physicians (RCP). National Mesothelioma Audit Report 2020 (Audit Period 2016–18); RCP: London, UK, 2020. Available online: www.rcplondon.ac.uk/projects/outputs/national-mesothelioma-audit-report-2020-audit-period-2016-18 (accessed on 2 May 2023).
10. Popat, S.; Baas, P.; Faivre-Finn, C.; Girard, N.; Nicholson, A.G.; Nowak, A.K.; Opitz, I.; Scherpereel, A.; Reck, M.; ESMO Guidelines Committee. Malignant pleural mesothelioma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2022, 33, 129–142. [CrossRef]
11. Shah, R.; Klotz, L.V.; Glade, J. Current Management and Future Perspective in Pleural Mesothelioma. Cancers 2022, 14, 1044. [CrossRef] [PubMed]
12. Vogelzang, N.J.; Rusthoven, J.J.; Symanowski, J.; Denham, C.; Kaukel, E.; Ruffie, P.; Gatzemeier, U.; Boyer, M.; Emri, S.; Manegold, C.; et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J. Clin. Oncol. 2003, 21, 2636–2644. [CrossRef]
13. Zalcman, G.; Mazieres, J.; Margery, J.; Greillier, L.; Audigier-Valette, C.; Moro-Sibilot, D.; Molinier, O.; Corre, R.; Monnet, I.; Gounant, V.; et al. Bevacizumab for newly diagnosed pleural mesothelioma in the Mesothelioma Avastin Cisplatin Pemetrexed Study (MAPS): A randomised, controlled, open-label, phase 3 trial. Lancet 2016, 387, 1405–1414. [CrossRef] [PubMed]
14. Nakajima, E.C.; Vellanki, P.J.; Larkins, E.; Chatterjee, S.; Mishra-Kalyani, P.S.; Bi, Y.; Qosa, H.; Liu, J.; Zhao, H.; Biable, M.; et al. FDA Approval Summary: Nivolumab in Combination with Ipilimumab for the Treatment of Unresectable Malignant Pleural Mesothelioma. Clin. Cancer Res. 2022, 28, 446–451. [CrossRef] [PubMed]
15. Baas, P.; Scherpereel, A.; Nowak, A.K.; Fujimoto, N.; Peters, S.; Tsao, A.S.; Mansfield, A.S.; Popat, S.; Jahan, T.; Antonia, S.; et al. First-line nivolumab plus 15 ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): A multicentre, 16 randomised, open-label, phase 3 trial. Lancet 2021, 397, 375–386.17. [CrossRef] [PubMed]
16. Woolhouse, I.; Bishop, L.; Darlison, L.; De Fonseka, D.; Edey, A.; Edwards, J.; Faivre-Finn, C.; Fennell, D.A.; Holmes, S.; Kerr,
K.M.; et al. British Thoracic Society Guideline for the investigation and management of malignant pleural mesothelioma. Thorax 2018, 73 (Suppl. S1), i1–i30. [CrossRef]
17. Scherpereel, A.; Opitz, I.; Berghmans, T.; Psallidas, I.; Glatzer, M.; Rigau, D.; Astoul, P.; B.lükbas, S.; Boyd, J.; Coolen, J.; et al. ERS/ESTS/EACTS/ESTRO guidelines for the management of malignant pleural mesothelioma. Eur. Respir. J. 2020, 55, 1900953. [CrossRef]
18. Pesch, B.; Brüning, T.; Johnen, G.; Casjens, S.; Bonberg, N.; Taeger, D.; Müller, A.;Weber, D.G.; Behrens, T. Biomarker research with prospective study designs for the early detection of cancer. Biochim. Biophys. Acta. 2014, 1844, 874–883. [CrossRef] [PubMed]
19. Liu, X.T.; Dong, X.L.; Zhang, Y.; Fang, P.; Shi, H.Y.; Ming, Z.J. Diagnostic value and safety of medical thoracoscopy for pleural effusion of different causes. World J. Clin. Cases. 2022, 10, 3088–3100. [CrossRef]
20. Dixon, G.; de Fonseka, D.; Maskell, N. Pleural controversies: Image guided biopsy vs. thoracoscopy for undiagnosed pleural effusions? J. Thorac. Dis. 2015, 7, 1041–1051. [PubMed] 21. Zhang, Y.; Li, N.; Li, R.; Gu, Y.; Liu, X.; Zhang, S. Predicting survival for patients with mesothelioma: Development of the PLACE prognostic model. BMC Cancer 2023, 23, 698. [CrossRef] [PubMed]
22. Yeap, B.Y.; De Rienzo, A.; Gill, R.R.; Oster, M.E.; Dao, M.N.; Dao, N.T.; Levy, R.D.; Vermilya, K.; Gustafson, C.E.; Ovsak, G.; et al. Mesothelioma Risk Score: A New Prognostic Pretreatment, Clinical-Molecular Algorithm for Malignant Pleural Mesothelioma. J. Thorac. Oncol. 2021, 16, 1925–1935. [CrossRef]
23. Ahmad, A.; Imran, M.; Ahsan, H. Biomarkers as Biomedical Bioindicators: Approaches and Techniques for the Detection, Analysis, and Validation of Novel Biomarkers of Diseases. Pharmaceutics 2023, 15, 1630. [CrossRef]
24. Zhang, M.; Yan, L.; Lippi, G.; Hu, Z.D. Pleural biomarkers in diagnostics of malignant pleural effusion: A narrative review. Transl. Lung Cancer Res. 2021, 10, 1557–1570. [CrossRef] [PubMed]
25. Schillebeeckx, E.; van Meerbeeck, J.P.; Lamote, K. Clinical utility of diagnostic biomarkers in malignant pleural mesothelioma: A systematic review and meta-analysis. Eur. Respir. Rev. 2021, 30, 210057. [CrossRef] [PubMed]
26. Gao, R.;Wang, F.;Wang, Z.;Wu, Y.; Xu, L.; Qin, Y.; Shi, H.; Tong, Z. Diagnostic value of soluble mesothelin-related peptides in pleural effusion for malignant pleural mesothelioma: An updated meta-analysis. Medicine 2019, 98, e14979. [CrossRef] [PubMed] 27. Cui, A.; Jin, X.G.; Zhai, K.; Tong, Z.H.; Shi, H.Z. Diagnostic values of soluble mesothelin-related peptides for malignant pleural mesothelioma: Updated meta-analysis. BMJ Open 2014, 4, e004145. [CrossRef] 28. Pass, H.I.; Levin, S.M.; Harbut, M.R.; Melamed, J.; Chiriboga, L.; Donington, J.; Huflejt, M.; Carbone, M.; Chia, D.; Goodglick, L.; et al. Fibulin-3 as a blood and effusion biomarker for pleural mesothelioma. N. Engl. J. Med. 2012, 367, 1417–1427; Erratum in N. Engl. J. Med. 2012, 367, 1768. [CrossRef]
29. Fujimoto, N.; Gemba, K.; Asano, M.; Fuchimoto, Y.; Wada, S.; Ono, K.; Ozaki, S.; Kishimoto, T. Hyaluronic acid in the pleural fluid of patients with malignant pleural mesothelioma. Respir. Investig. 2013, 51, 92–97. [CrossRef]
30. Birnie, K.A.; Prêle, C.M.; Musk, A.W.B.; de Klerk, N.; Lee, Y.C.G.; Fitzgerald, D.; Allcock, R.J.N.; Thompson, P.J.; Creaney, J.; Badrian, B.; et al. MicroRNA signatures in malignant pleural mesothelioma effusions. Dis. Markers 2019, 2019, 8628612. [CrossRef]
31. Filiberti, R.; Parodi, S.; Libener, R.; Ivaldi, G.P.; Canessa, P.A.; Ugolini, D.; Bobbio, B.; Marroni, P. Diagnostic value of mesothelin in pleural fluids: Comparison with CYFRA 21-1 and CEA. Med. Oncol. 2013, 30, 543. [CrossRef]
32. Husain, A.N.; Colby, T.V.; Ordóñez, N.G.; Allen, T.C.; Attanoos, R.L.; Beasley, M.B.; Butnor, K.J.; Chirieac, L.R.; Churg, A.M.; Dacic, S.; et al. Guidelines for Pathologic Diagnosis of Malignant Mesothelioma 2017 Update of the Consensus Statement from the International Mesothelioma Interest Group. Arch. Pathol. Lab. Med. 2018, 142, 89–108. [CrossRef]
33. Casjens, S.; Weber, D.G.; Johnen, G.; Raiko, I.; Taeger, D.; Meinig, C.; Moebus, S.; Jöckel, K.-H.; Brüning, T.; Pesch, B. Assessment of potential predictors of calretinin and mesothelin to improve the diagnostic performance to detect malignant mesothelioma: Results from a population-based cohort study. BMJ Open 2017, 7, e017104. [CrossRef]
34. Creaney, J.; Sneddon, S.; Dick, I.M.; Dare, H.; Boudville, N.; Musk, A.W.; Skates, S.J.; Robinson, B.W. Comparison of the diagnostic accuracy of the MSLN gene products, mesothelin and megakaryocyte potentiating factor, as biomarkers for mesothelioma in pleural effusions and serum. Dis. Markers 2013, 35, 119–127. [CrossRef]
35. Yu, Y.; Ryan, B.M.; Thomas, A.; Morrow, B.; Zhang, J.; Kang, Z.; Zingone, A.; Onda, M.; Hassan, R.; Pastan, I.; et al. Elevated
Serum Megakaryocyte Potentiating Factor as a Predictor of Poor Survival in Patients with Mesothelioma and Primary Lung Cancer. J. Appl. Lab. Med. 2018, 3, 166–177. [CrossRef]
36. Napolitano, A.; Antoine, D.J.; Pellegrini, L.; Baumann, F.; Pagano, I.; Pastorino, S.; Goparaju, C.M.; Prokrym, K.; Canino, C.; Pass, H.I.; et al. HMGB1 and Its Hyperacetylated Isoform are Sensitive and Specific Serum Biomarkers to Detect Asbestos Exposure
and to Identify Mesothelioma Patients. Clin. Cancer Res. 2016, 22, 3087–3096. [CrossRef] [PubMed]
37. Creaney, J.; Yeoman, D.; Demelker, Y.; Segal, A.; Musk, A.; Skates, S.J.; Robinson, B.W. Comparison of osteopontin, megakaryocyte potentiating factor, and mesothelin proteins as markers in the serum of patients with malignant mesothelioma. J. Thorac. Oncol. 2008, 3, 851–857. [CrossRef]
38. Arnold, D.T.; De Fonseka, D.; Hamilton, F.W.; Rahman, N.M.; Maskell, N.A. Prognostication and monitoring of mesothelioma using biomarkers: A systematic review. Br. J. Cancer 2017, 116, 731–741. [CrossRef]
39. Pass, H.I.; Alimi, M.; Carbone, M.; Yang, H.; Goparaju, C.M. Mesothelioma Biomarkers: A Review Highlighting Contributions from the Early Detection Research Network. Cancer Epidemiol. Biomark. Prev. 2020, 29, 2524–2540. [CrossRef]
40. Hollevoet, K.; Nackaerts, K.; Gosselin, R.; DeWever,W.; Bosquée, L.; De Vuyst, P.; Germonpré, P.; Kellen, E.; Legrand, C.; Kishi, Y.; et al. Soluble mesothelin, megakaryocyte potentiating factor, and osteopontin as markers of patient response and outcome in mesothelioma. J. Thorac. Oncol. 2011, 6, 1930–1937. [CrossRef]
41. Weber, D.G.; Gawrych, K.; Casjens, S.; Brik, A.; Lehnert, M.; Taeger, D.; Pesch, B.; Kollmeier, J.; Bauer, T.T.; Johnen, G.; et al.
Circulating miR-132-3p as a Candidate Diagnostic Biomarker for Malignant Mesothelioma. Dis. Markers. 2017, 2017, 9280170.
[CrossRef] [PubMed]
42. Munson, P.B.; Hall, E.M.; Farina, N.H.; Pass, H.I.; Shukla, A. Exosomal miR-16-5p as a target for malignant mesothelioma. Sci.
Rep. 2019, 9, 11688. [CrossRef]
43. Cavalleri, T.; Angelici, L.; Favero, C.; Dioni, L.; Mensi, C.; Bareggi, C.; Palleschi, A.; Rimessi, A.; Consonni, D.; Bordini, L.; et al. Plasmatic extracellular vesicle microRNAs in malignant pleural mesothelioma and asbestos-exposed subjects suggest a 2-miRNA signature as potential biomarker of disease. PLoS ONE 2017, 12, e0176680. [CrossRef]
44. Tomasetti, M.; Monaco, F.; Strogovets, O.; Volpini, L.; Valentino, M.; Amati, M.; Neuzil, J.; Santarelli, L. ATG5 as biomarker for early detection of malignant mesothelioma. BMC Res. Notes 2023, 16, 61. [CrossRef] [PubMed]
45. Weber, D.G.; Casjens, S.; Brik, A.; Raiko, I.; Lehnert, M.; Taeger, D.; Gleichenhagen, J.; Kollmeier, J.; Bauer, T.T.; Brüning, T.
Circulating long non-coding RNA GAS5 (growth arrest-specific transcript 5) as a complement marker for the detection of malignant mesothelioma using liquid biopsies. Biomark. Res. 2020, 8, 15. [CrossRef]
46. Matboli, M.; Shafei, A.E.; Ali, M.A.; Gaber, A.I.; Galal, A.; Tarek, O.; Marei, M.; Khairy, E.; El-Khazragy, N.; Anber, N.; et al. Clinical significance of serum DRAM1 mRNA, ARSA mRNA, hsa-miR-2053 and lncRNA-RP1-86D1.3 axis expression in malignant pleural mesothelioma. J. Cell Biochem. 2019, 120, 3203–3211. [CrossRef] [PubMed]
47. Ho, M.; Bera, T.K.; Willingham, M.C.; Onda, M.; Hassan, R.; FitzGerald, D.; Pastan, I. Mesothelin expression in human lung cancer. Clin. Cancer Res. 2007, 13, 1571–1575. [CrossRef] [PubMed]
48. Lv, J.; Li, P. Mesothelin as a biomarker for targeted therapy. Biomark. Res. 2019, 7, 18. [CrossRef]
49. Maeda, M.; Hino, O. Blood tests for asbestos-related mesothelioma. Oncology 2006, 71, 26–31. [CrossRef] [PubMed]
50. Chang, K.; Pai, L.H.; Pass, H.; Pogrebniak, H.W.; Tsao, M.S.; Pastan, I.;Willingham, M.C. Monoclonal antibody K1 reacts with epithelial mesothelioma but not with lung adenocarcinoma. Am. J. Surg. Pathol. 1992, 16, 259–268. [CrossRef]
51. Ordóñez, N.G. Value of mesothelin immunostaining in the diagnosis of mesothelioma. Mod. Pathol. 2003, 16, 192–197. [CrossRef] [PubMed]
52. Ordóñez, N.G. What are the current best immunohistochemical markers for the diagnosis of epithelioid mesothelioma? A review and update. Hum. Pathol. 2007, 38, 1–16. [CrossRef]
53. Kaya, H.; Demir, M.; Taylan, M.; Sezgi, C.; Tanrikulu, A.C.; Yilmaz, S.; Bayram, M.; Kaplan, I.; Senyigit, A. Fibulin-3 as a diagnostic biomarker in patients with malignant mesothelioma. Asian Pac. J. Cancer Prev. 2015, 16, 1403–1407. [CrossRef]
54. Livingstone, I.; Uversky, V.N.; Furniss, D.;Wiberg, A. The Pathophysiological Significance of Fibulin-3. Biomolecules 2020, 10, 1294. [CrossRef]
55. Battolla, E.; Canessa, P.A.; Ferro, P.; Franceschini, M.C.; Fontana, V.; Dessanti, P.; Pinelli, V.; Morabito, A.; Fedeli, F.; Pistillo, M.P.; et al. Comparison of the Diagnostic Performance of Fibulin-3 and Mesothelin in Patients with Pleural Effusions from Malignant Mesothelioma. Anticancer Res. 2017, 37, 1387–1391. [PubMed]
56. Ledda, C.; Senia, P.; Rapisarda, V. Biomarkers for Early Diagnosis and Prognosis of Malignant Pleural Mesothelioma: The Quest Goes on. Cancers 2018, 10, 203. [CrossRef]
57. Creaney, J.; Dick, I.M.; Meniawy, T.M.; Leong, S.L.; Leon, J.S.; Demelker, Y.; Segal, A.; Musk, A.W.; Lee, Y.C.G.; Skates, S.J.; et al. Comparison of fibulin-3 and mesothelin as markers in malignant mesothelioma. Thorax 2014, 69, 895–902. [CrossRef]
58. Joy, R.A.; Vikkath, N.; Ariyannur, P.S. Metabolism and mechanisms of action of hyaluronan in human biology. Drug Metab. Pers. Ther. 2018, 33, 15–32. [CrossRef]
59. Asplund, T.; Versnel, M.A.; Laurent, T.C.; Heldin, P. Human mesothelioma cells produce factors that stimulate the production of hyaluronan by mesothelial cells and fibroblasts. Cancer Res. 1993, 53, 388–392.
60. Creaney, J.; Dick, I.M.; Segal, A.; Musk, A.W.; Robinson, B.W. Pleural effusion hyaluronic acid as a prognostic marker in pleural malignant mesothelioma. Lung Cancer 2013, 82, 491–498. [CrossRef] [PubMed]
61. Smolarz, B.; Durczy ´ nski, A.; Romanowicz, H.; Szyłło, K.; Hogendorf, P. miRNAs in Cancer (Review of Literature). Int. J. Mol. Sci. 2022, 23, 2805. [CrossRef] [PubMed]
62. Liu, L.; Xie, W.; Xue, P.; Wei, Z.; Liang, X.; Chen, N. Diagnostic accuracy and prognostic applications of CYFRA 21-1 in head and neck cancer: A systematic review and meta-analysis. PLoS ONE 2019, 14, e0216561. [CrossRef] [PubMed]
63. Hegmans, J.; Veltman, J.D.; Fung, E.T.; Verch, T.; Glover, C.; Zhang, F.; Allard, W.J.; T’Jampens, D.; Hoogsteden, H.C.; Lambrecht, B.N.; et al. Protein profiling of pleural effusions to identify malignant pleural mesothelioma using SELDI-TOF MS. Technol. Cancer Res. Treat. 2009, 8, 323–332. [CrossRef] [PubMed]
64. Fuhrman, C.; Duche, J.C.; Chouaid, C.; Alsamad, I.A.; Atassi, K.; Monnet, I.; Tillement, J.; Housset, B. Use of tumor markers for differential diagnosis of mesothelioma and secondary pleural malignancies. Clin. Biochem. 2000, 33, 405–410. [CrossRef]
65. Wang, X.F.;Wu, Y.H.;Wang, M.S.;Wang, Y.S. CEA, AFP, CA125, CA153 and CA199 in malignant pleural effusions predict the cause. Asian Pac. J. Cancer Prev. 2014, 15, 363–368. [CrossRef] [PubMed]
66. Mundt, F.; Nilsonne, G.; Arslan, S.; Csür.s, K.; Hillerdal, G.; Yildirim, H.; Metintas, M.; Dobra, K.; Hjerpe, A. Hyaluronan and N-ERC/mesothelin as key biomarkers in a specific two-step model to predict pleural malignant mesothelioma. PLoS ONE 2013, 8, e72030. [CrossRef]
67. Palstrøm, N.B.; Overgaard, M.; Licht, P.; Beck, H.C. Identification of Highly Sensitive Pleural Effusion Protein Biomarkers for Malignant Pleural Mesothelioma by Affinity-Based Quantitative Proteomics. Cancers 2023, 15, 641. [CrossRef] [PubMed]
68. Henderson, D.W.; Reid, G.; Kao, S.C.; van Zandwijk, N.; Klebe, S. Challenges and controversies in the diagnosis of mesothelioma: Part 1. Cytology-only diagnosis, biopsies, immunohistochemistry, discrimination between mesothelioma and reactive mesothelial hyperplasia, and biomarkers. J. Clin. Pathol. 2013, 66, 847–853. [CrossRef] [PubMed]
69. Erber, R.;Warth, A.; Muley, T.; Hartmann, A.; Herpel, E.; Agaimy, A. BAP1 Loss is a Useful Adjunct to Distinguish Malignant
Mesothelioma Including the Adenomatoid-like Variant From Benign Adenomatoid Tumors. Appl. Immunohistochem. Mol. Morphol. 2020, 28, 67–73. [CrossRef]
70. Biancosino, C.; van der Linde, L.I.S.; Sauter, G.; Stellmacher, F.; Krüger, M.; Welker, L. Cytological Diagnostic Procedures in
Malignant Mesothelioma. Adv. Exp. Med. Biol. 2022, 1374, 41–49.
71. Straccia, P.; Magnini, D.; Trisolini, R.; Lococo, F.; Chiappetta, M.; Cancellieri, A. The value of cytology in distinguishing malignant mesothelioma: An institutional experience of 210 cases reclassified according to the International System for Reporting Serous Fluid Cytopathology (ISRSFC). Cytopathology 2022, 33, 77–83. [CrossRef]
72. Wang, J.J.; Yan, L. Serum diagnostic markers for malignant pleural mesothelioma: A narrative review. Transl. Cancer Res. 2022, 11, 4434–4440. [CrossRef]
73. Yeo, D.; Castelletti, L.; van Zandwijk, N.; Rasko, J.E.J. Hitting the Bull’s-Eye: Mesothelin’s Role as a Biomarker and Therapeutic Target for Malignant Pleural Mesothelioma. Cancers 2021, 13, 3932. [CrossRef]
74. Hollevoet, K.; Reitsma, J.B.; Creaney, J.; Grigoriu, B.D.; Robinson, B.W.; Scherpereel, A.; Cristaudo, A.; Pass, H.I.; Nackaerts, K.; Portal, J.A.R.; et al. Serum mesothelin for diagnosing malignant pleural mesothelioma: An individual patient data meta-analysis. J. Clin. Oncol. 2012, 30, 1541–1549. [CrossRef]
75. Hollevoet, K.; Nackaerts, K.; Thimpont, J.; Germonpré, P.; Bosquée, L.; De Vuyst, P.; Legrand, C.; Kellen, E.; Kishi, Y.; Delanghe, J.R.; et al. Diagnostic performance of soluble mesothelin and megakaryocyte potentiating factor in mesothelioma. Am. J. Respir. Crit. Care Med. 2010, 181, 620–625. [CrossRef]
76. Tian, L.; Zeng, R.;Wang, X.; Shen, C.; Lai, Y.;Wang, M.; Che, G. Prognostic significance of soluble mesothelin in malignant pleural mesothelioma: A meta-analysis. Oncotarget 2017, 8, 46425–46435. [CrossRef] [PubMed]
77. Goricar, K.; Kovac, V.; Dodic-Fikfak, M.; Dolzan, V.; Franko, A. Evaluation of soluble mesothelin-related peptides and MSLN genetic variability in asbestos-related diseases. Radiol. Oncol. 2020, 54, 86–95. [CrossRef]
78. Fontana, V.; Pistillo, M.P.; Vigani, A.; Canessa, P.A.; Berisso, G.; Giannoni, U.; Ferro, P.; Franceschini, M.C.; Carosio, R.; Tonarelli, M.; et al. Determination of Mesothelin Levels in Pleural Effusion Does Not Help Predict Survival of Patients With Malignant Pleural Mesothelioma. Anticancer Res. 2019, 39, 5219–5223. [CrossRef]
79. Forest, F.; Patoir, A.; Dal Col, P.; Sulaiman, A.; Camy, F.; Laville, D.; Bayle-Bleuez, S.; Fournel, P.; Habougit, C. Nuclear grading, BAP1, mesothelin and PD-L1 expression in malignant pleural mesothelioma: Prognostic implications. Pathology 2018, 50, 635–641. [CrossRef]
80. Hollevoet, K.; Nackaerts, K.; Thas, O.; Thimpont, J.; Germonpré, P.; De Vuyst, P.; Bosquée, L.; Legrand, C.; Kellen, E.; Kishi, Y.; et al. The effect of clinical covariates on the diagnostic and prognostic value of soluble mesothelin and megakaryocyte potentiating factor. Chest 2012, 141, 477–484. [CrossRef]
81. Katz, S.I.; Roshkovan, L.; Berger, I.; Friedberg, J.S.; Alley, E.W.; Simone, C.B., 2nd; Haas, A.R.; Cengel, K.A.; Sterman, D.H.; Albelda, S.M. Serum soluble mesothelin-related protein (SMRP) and fibulin-3 levels correlate with baseline malignant pleural mesothelioma (PM) tumor volumes but are not useful as biomarkers of response in an immunotherapy trial. Lung Cancer 2021, 154, 5–12. [CrossRef]
82. Grigoriu, B.D.; Chahine, B.; Vachani, A.; Gey, T.; Conti, M.; Sterman, D.H.; Marchandise, G.; Porte, H.; Albelda, S.M.; Scherpereel, A. Kinetics of soluble mesothelin in patients with malignant pleural mesothelioma during treatment. Am. J. Respir. Crit. Care Med. 2009, 179, 950–954. [CrossRef] [PubMed]
83. Creaney, J.; Francis, R.J.; Dick, I.M.; Musk, A.W.; Robinson, B.W.S.; Byrne, M.J.; Nowak, A.K. Serum soluble mesothelin concentrations in malignant pleural mesothelioma: Relationship to tumor volume, clinical stage and changes in tumor burden. Clin. Cancer Res. 2011, 17, 1181–1189. [CrossRef] [PubMed]
84. Wheatley-Price, P.; Yang, B.; Patsios, D.; Patel, D.; Ma, C.; Xu, W.; Leighl, N.; Feld, R.; Cho, B.J.; O’Sullivan, B.; et al. Soluble mesothelin-related Peptide and osteopontin as markers of response in malignant mesothelioma. J. Clin. Oncol. 2010, 28, 3316–3322.
[CrossRef] [PubMed]
85. De Fonseka, D.; Arnold, D.T.; Stadon, L.; Morley, A.; Keenan, E.; Darby, M.; Armstrong, L.; Virgo, P.; Maskell, N.A. A prospective study to investigate the role of serial serum mesothelin in monitoring mesothelioma. BMC Cancer 2018, 18, 199. [CrossRef]
86. Grosso, F.; Mannucci, M.; Ugo, F.; Ferro, P.; Cassinari, M.; Vigani, A.; De Angelis, A.M.; Delfanti, S.; Lia, M.; Guaschino, R.;
et al. Pilot Study to Evaluate Serum Soluble Mesothelin-Related Peptide (SMRP) as Marker for Clinical Monitoring of Pleural
Mesothelioma (PM): Correlation with Modified RECIST Score. Diagnostics 2021, 11, 2015. [CrossRef] [PubMed]
87. Burt, B.M.; Lee, H.-S.; De Rosen, V.L.; Hamaji, M.; Groth, S.S.; Wheeler, T.M.; Sugarbaker, D.J. Soluble Mesothelin-Related Peptides to Monitor Recurrence after Resection of Pleural Mesothelioma. Ann. Thorac. Surg. 2017, 104, 1679–1687. [CrossRef] [PubMed]
88. Roshini, A.; Goparaju, C.; Kundu, S.; Nandhu, M.S.; Longo, S.L.; Longo, J.A.; Chou, J.; Middleton, F.A.; Pass, H.I.; Viapiano, M.S. The extracellular matrix protein fibulin-3/EFEMP1 promotes pleural mesothelioma growth by activation of PI3K/Akt signaling. Front. Oncol. 2022, 12, 1014749. [CrossRef] [PubMed]
89. Wang, Y.; Jiang, Z.; Yan, J.; Ying, S. HMGB1 as a Potential Biomarker and Therapeutic Target for Malignant Mesothelioma. Dis. Markers 2019, 2019, 4183157. [CrossRef] [PubMed]
90. Tomasetti, M.; Staffolani, S.; Nocchi, L.; Neuzil, J.; Strafella, E.; Manzella, N.; Mariotti, L.; Bracci, M.; Valentino, M.; Amati, M.; et al. Clinical significance of circulating miR-126 quantification in malignant mesothelioma patients. Clin. Biochem. 2012, 45,
75–581. [CrossRef]
91. Zhang, L.; Zhou, Q.; Han, Y.Q.; Li, P.; Ouyang, P.H.; Wang, M.Y.; Hu, Z.D. Diagnostic accuracy of circulating miR-126 for malignant pleural mesothelioma: A systematic review and meta-analysis. Transl. Cancer Res. 2021, 10, 1856–1862. [CrossRef]
92. Reid, G.; Johnson, T.G.; van Zandwijk, N. Manipulating microRNAs for the Treatment of Malignant Pleural Mesothelioma: Past, Present and Future. Front. Oncol. 2020, 10, 105. [CrossRef]
93. Birnie, K.A.; Prêle, C.M.; Thompson, P.J.; Badrian, B.; Mutsaers, S.E. Targeting microRNA to improve diagnostic and therapeutic approaches for malignant mesothelioma. Oncotarget 2017, 8, 78193–78207. [CrossRef] [PubMed]
94. Creaney, J.; Yeoman, D.; Musk, A.W.; de Klerk, N.; Skates, S.J.; Robinson, B.W. Plasma versus serum levels of osteopontin and mesothelin in patients with malignant mesothelioma—Which is best? Lung Cancer. 2011, 74, 55–60. [CrossRef] [PubMed]
95. Grigoriu, B.D.; Scherpereel, A.; Devos, P.; Chahine, B.; Letourneux, M.; Lebailly, P.; Grégoire, M.; Porte, H.; Copin, M.-C.; Lassalle, P. Utility of osteopontin and serum mesothelin in malignant pleural mesothelioma diagnosis and prognosis assessment. Clin. Cancer Res. 2007, 13, 2928–2935. [CrossRef] [PubMed]
96. Cristaudo, A.; Foddis, R.; Bonotti, A.; Simonini, S.; Vivaldi, A.; Guglielmi, G.; Ambrosino, N.; Canessa, P.A.; Chella, A.; Lucchi, M.; et al. Comparison between plasma and serum osteopontin levels: Usefulness in diagnosis of epithelial malignant pleural mesothelioma. Int. J. Biol. Markers 2010, 25, 164–170. [CrossRef]
97. Hattori, T.; Iwasaki-Hozumi, H.; Bai, G.; Chagan-Yasutan, H.; Shete, A.; Telan, E.F.; Takahashi, A.; Ashino, Y.; Matsuba, T. Both Full-Length and Protease-Cleaved Products of Osteopontin Are Elevated in Infectious Diseases. Biomedicines 2021, 9, 1006. [CrossRef] [PubMed]
98. Kirschner, M.B.; Pulford, E.; Hoda, M.A.; Rozsas, A.; Griggs, K.; Cheng, Y.Y.; Edelman, J.J.B.; Kao, S.C.; Hyland, R.; Dong, Y.; et al. Fibulin-3 levels in malignant pleural mesothelioma are associated with prognosis but not diagnosis. Br. J. Cancer 2015, 113, 963–969. [CrossRef] [PubMed]
99. Tsim, S.; Alexander, L.; Kelly, C.; Shaw, A.; Hinsley, S.; Clark, S.; Evison, M.; Holme, J.; Cameron, E.J.; Sharma, D.; et al. Serum Proteomics and Plasma Fibulin-3 in Differentiation of Mesothelioma from Asbestos-Exposed Controls and Patients with Other Pleural Diseases. J. Thorac. Oncol. 2021, 16, 1705–1717. [CrossRef] [PubMed]
100. Pei, D.; Li, Y.; Liu, X.; Yan, S.; Guo, X.; Xu, X.; Guo, X. Diagnostic and prognostic utilities of humoral fibulin-3 in malignant pleural mesothelioma: Evidence from a meta-analysis. Oncotarget 2017, 8, 13030–13038. [CrossRef]
101. Raiko, I.; Sander, I.; Weber, D.G.; Raulf-Heimsoth, M.; Gillissen, A.; Kollmeier, J.; Scherpereel, A.; Brüning, T.; Johnen, G. Development of an enzyme-linked immunosorbent assay for the detection of human calretinin in plasma and serum of mesothelioma patients. BMC Cancer 2010, 10, 242. [CrossRef]
102. Blum,W.; Pecze, L.; Felley-Bosco, E.; Schwaller, B. Overexpression or absence of calretinin in mouse primary mesothelial cells
inversely affects proliferation and cell migration. Respir. Res. 2015, 16, 153. [CrossRef] [PubMed]
103. Johnen, G.; Gawrych, K.; Raiko, I.; Casjens, S.; Pesch, B.; Weber, D.G.; Taeger, D.; Lehnert, M.; Kollmeier, J.; Bauer, T.; et al. Calretinin as a blood-based biomarker for mesothelioma. BMC Cancer 2017, 17, 386. [CrossRef]
104. Johnen, G.; Burek, K.; Raiko, I.; Wichert, K.; Pesch, B.; Weber, D.G.; Lehnert, M.; Casjens, S.; Hagemeyer, O.; Taeger, D.; et al. Prediagnostic detection of mesothelioma by circulating calretinin and mesothelin—A case-control comparison nested into a prospective cohort of asbestos-exposed workers. Sci. Rep. 2018, 8, 14321. [CrossRef] [PubMed]
105. Han, Y.Q.; Xu, S.C.; Zheng, W.Q.; Hu, Z.D. Diagnostic value of microRNAs for malignant pleural mesothelioma: A mini-review. Thorac. Cancer 2021, 12, 8–12. [CrossRef]
106. Santarelli, L.; Strafella, E.; Staffolani, S.; Amati, M.; Emanuelli, M.; Sartini, D.; Pozzi, V.; Carbonari, D.; Bracci, M.; Pignotti, E.; et al. Association of MiR-126 with soluble mesothelin-related peptides, a marker for malignant mesothelioma. PLoS ONE 2011, 6, e18232. [CrossRef] [PubMed]
107. Singh, A.; Pruett, N.; Pahwa, R.; Mahajan, A.P.; Schrump, D.S.; Hoang, C.D. MicroRNA-206 suppresses mesothelioma progression via the Ras signaling axis. Mol. Ther. Nucleic Acids 2021, 24, 669–681. [CrossRef] [PubMed]
108. Raei, N.; Safaralizadeh, R.; Latifi-Navid, S. Clinical application of circulating tumor DNA in metastatic cancers. Expert Rev. Mol. Diagn. 2023, 1–12. [CrossRef]
109. Hylebos, M.; de Beeck, K.O.; Pauwels, P.; Zwaenepoel, K.; van Meerbeeck, J.P.; Van Camp, G. Tumor-specific genetic variants can be detected in circulating cell-free DNA of malignant pleural mesothelioma patients. Lung Cancer 2018, 124, 19–22. [CrossRef] [PubMed]
110. Christensen, B.C.; Godleski, J.J.; Marsit, C.J.; Houseman, E.A.; Lopez-Fagundo, C.Y.; Longacker, J.L.; Bueno, R.; Sugarbaker, D.J.; Nelson, H.H.; Kelsey, K.T. Asbestos exposure predicts cell cycle control gene promoter methylation in pleural mesothelioma. Carcinogenesis 2008, 29, 1555–1559. [CrossRef] [PubMed]
111. Nocchi, L.; Tomasetti, M.; Amati, M.; Neuzil, J.; Santarelli, L.; Saccucci, F. Thrombomodulin is silenced in malignant mesothelioma by a poly(ADP-ribose) polymerase-1-mediated epigenetic mechanism. J. Biol. Chem. 2011, 286, 19478–19488. [CrossRef]
112. Santarelli, L.; Staffolani, S.; Strafella, E.; Nocchi, L.; Manzella, N.; Grossi, P.; Bracci, M.; Pignotti, E.; Alleva, R.; Borghi, B.; et al. Combined circulating epigenetic markers to improve mesothelin performance in the diagnosis of malignant mesothelioma. Lung Cancer 2015, 90, 457–464. [CrossRef]
113. Guarrera, S.; Viberti, C.; Cugliari, G.; Allione, A.; Casalone, E.; Betti, M.; Ferrante, D.; Aspesi, A.; Casadio, C.; Grosso, F.; et al. Peripheral Blood DNA Methylation as Potential Biomarker of Malignant Pleural Mesothelioma in Asbestos-Exposed Subjects. J. Thorac. Oncol. 2019, 14, 527–539. [CrossRef]
114. Napolitano, A.; Antoine, D.J.; Pellegrini, L.; Baumann, F.; Pagano, I.; Pastorino, S.; Goparaju, C.M.; Prokrym, K.; Canino, C.; Pass, H.I.; et al. Expression of Concern: HMGB1 and Its Hyperacetylated Isoform are Sensitive and Specific Serum Biomarkers to Detect Asbestos Exposure and to Identify Mesothelioma Patients. Clin. Cancer Res. 2020, 26, 1529. [CrossRef]
115. Ying, S.; Jiang, Z.; He, X.; Yu, M.; Chen, R.; Chen, J.; Ru, G.; Chen, Y.; Chen, W.; Zhu, L.; et al. Serum HMGB1 as a Potential Biomarker for Patients with Asbestos-Related Diseases. Dis. Markers 2017, 2017, 5756102. [CrossRef] [PubMed]
116. Cunningham, G.M.; Roman, M.G.; Flores, L.C.; Hubbard, G.B.; Salmon, A.B.; Zhang, Y.; Gelfond, J.; Ikeno, Y. The paradoxical role of thioredoxin on oxidative stress and aging. Arch. Biochem. Biophys. 2015, 576, 32–38. [CrossRef] [PubMed]
117. Demir, M.; Kaya, H.; Taylan, M.; Ekinci, A.; Yılmaz, S.; Teke, F.; Sezgi, C.; Tanrikulu, A.C.; Meteroglu, F.; Senyigit, A. Evaluation of New Biomarkers in the Prediction of Malignant Mesothelioma in Subjects with Environmental Asbestos Exposure. Lung 2016, 194, 409–417. [CrossRef]
118. Hirayama, N.; Tabata, C.; Tabata, R.; Maeda, R.; Yasumitsu, A.; Yamada, S.; Kuribayashi, K.; Fukuoka, K.; Nakano, T. Pleural effusion VEGF levels as a prognostic factor of malignant pleural mesothelioma. Respir. Med. 2011, 105, 137–142. [CrossRef] [PubMed]
119. Yasumitsu, A.; Tabata, C.; Tabata, R.; Hirayama, N.; Murakami, A.; Yamada, S.; Terada, T.; Iida, S.; Tamura, K.; Fukuoka, K.; et al. Clinical significance of serum vascular endothelial growth factor in malignant pleural mesothelioma. J. Thorac. Oncol. 2010, 5, 479–483. [CrossRef] [PubMed]
120. Cristaudo, A.; Bonotti, A.; Guglielmi, G.; Fallahi, P.; Foddis, R. Serum mesothelin and other biomarkers: What have we learned in the last decade? J. Thorac. Dis. 2018, 10 (Suppl. S2), S353–S359. [CrossRef]
121. Rai, A.J.; Flores, R.M. Association of malignant mesothelioma and asbestos related conditions with ovarian cancer: Shared biomarkers and a possible etiological link? Clin. Chem. Lab. Med. 2011, 49, 5–7. [CrossRef]
122. Muley, T.; Dienemann, H.; Herth, F.J.; Thomas, M.; Meister, M.; Schneider, J. Combination of mesothelin and CEA significantly improves the differentiation between malignant pleural mesothelioma, benign asbestos disease, and lung cancer. J. Thorac. Oncol. 2013, 8, 947–951. [CrossRef]
123. Corradi, M.; Goldoni, M.; Alinovi, R.; Tiseo, M.; Ampollini, L.; Bonini, S.; Carbognani, P.; Casalini, A.; Mutti, A. YKL-40 and mesothelin in the blood of patients with malignant mesothelioma, lung cancer and asbestosis. Anticancer Res. 2013, 33, 5517–5524.
124. Bonotti, A.; Foddis, R.; Landi, S.; Melaiu, O.; De Santi, C.; Giusti, L.; Donadio, E.; Ciregia, F.; Mazzoni, M.R.; Lucacchini, A.; et al. A Novel Panel of Serum Biomarkers for PM Diagnosis. Dis. Markers 2017, 2017, 3510984. [CrossRef] [PubMed]
125. Lu, Z.; Zhang, W.; Huang, K.; Zhu, M.; Gu, X.; Wei, D.; Shi, M.; Chen, Y.; Wang, H. Systematic Review, Meta-Analysis and Bioinformatic Analysis of Biomarkers for Prognosis of Malignant Pleural Mesothelioma. Diagnostics 2022, 12, 2210. [CrossRef] [PubMed]
126. Lagniau, S.; Lamote, K.; van Meerbeeck, J.P.; Vermaelen, K.Y. Biomarkers for early diagnosis of malignant mesothelioma: Do we need another moonshot? Oncotarget 2017, 8, 53751–53762. [CrossRef] [PubMed]